
Trong đó:
C%: Nồng độ xác suất mct: cân nặng chất rã mdd: cân nặng dung dịch khía cạnh khác: mdd = mct + mdm ( mdm là khối lượng của dung môi)Ví dụ: hòa tan 50g muối vào 200g nước, tính nồng độ phần trăm của dung dịch.
Bạn đang xem: Lý thuyết tính theo công thức hóa học
Giải: Nước ở đó là dung môi nên ta có mdd= mct+mdm= 50+200 = 250g
ta bao gồm C%= (mct/mdd)*100%= (50/250)*100%= 20%
2.1.2. Bí quyết tính mật độ mol

Ví dụ: tổ hợp 1,25 mol Na
Cl vào 5l nước.
Giải: CM=nct/Vdd= 1,25/5=0,25 (mol/l)
2.1.3. Cách làm tính khối lượng
m=n*M
m: khối lượng n: Số mol M: cân nặng molVí dụ; tính khối lượng của 3,6 mol đồng biết khối lượng mon của Cu=64g
Giải: Khối lượngm=n*M = 3,6*64 =230,4(g)
2.2.Công thức chất hóa học lớp 10, lớp 11 với 12
Khi bắt đầu học cấp cho 3, các em sẽ được tìm hiểu sâu rộng về môn hóa học. Các bài toán hóahọc đòi hỏi tư duy các hơn không ít so với công tác học THCS. Thời gian này, để học xuất sắc hóa các bạn cần phải học thêm không hề ít các công thức cải thiện liên quan tới đồng đẳng, đồng phân, cách tính số hạt notron, electron, pronton vào hóa học.
Tôi xin gửi tới chúng ta một số bí quyết hóa cơ phiên bản ở bậc học tập THPT
2.2.1. Công thức tổng quát tính este đối chọi chức no, mạch hở:(C_n
H_2nO_2)( n>=2)
=> Số đồng phânCn
H2n
O2 = (C_n
H_2nO_2=2^n-2)
Ví dụ:Số đồng phân của este solo chức no, mạch hở có công thức (C_2H_4O_2) là:(2^2-2=1)
2.2.2. Bí quyết tínhamin no, 1-1 chức mạch hở:(C_n
H_2n + 3N)
=> Số đồng phân(C_n
H_2n + 3N = 2^n-1)(n
Ví dụ:Số đồng phân (C_2H_7N = 2^2-1=2)
2.2.3. Số đồng phân ankan:
Công thức: (C_n
H_2n+2=2^n−4+1)
2.2.4. Số đồng phân Hiđro cacbon thơm là đồng đẳng benzen:
Công thức: (C_n
H_2n−6=(n−6)^2)
2.2.5. Số đồng phân phenol đối kháng chức
Công thức: (C_n
H_2(n−6)O=3^n−6)
2.2.6. Số đồng phân ancol đơn chức no Cn
H2n+2O:
Công thức: (C_n
H_2n+2O=2^n−2) (n
2.2.7. Số đồng phân andehit đối chọi chức no Cn
H2n
O:
Công thức: (C_n
H_2nO=2^n−3) (n
2.2.8. Số đồng phân axit cacboxylict 1-1 chức no Cn
H2n
O2:
Công thức: (C_n
H_2nO_2=2^n−3) (n
2.2.9. Số đồng phân amin đối chọi chức no Cn
H2n+3N:
Công thức: Số amin (C_n
H_2n+3N=2^n−1) (n
2.2.10. Số đồng phân amino axit, no (có 1nhóm NH2 cùng 1 team COOH)
Công thức: Cn
H(2n+1)O2N=(n!−1) (n
2.2.11. Số đồng phân trieste tạo bởi vì glyxerol và các thành phần hỗn hợp n axit béo:
Công thức: Số trieste = n2(n+1)/2
2.2.12. Số đồng phân xeton 1-1 chức no Cn
H2n
O:
Công thức: Số Xeton Cn
H2n
O=(n−2)(n−3)/2 (3
3. Phương thức ghi lưu giữ cáccông thức hóa học
3.1. Liên tiếp luyện đề, rèn luyện khả năng luyện tập môn hóa học
Môn hóa đua đòi hỏi chúng ta phải nghiên cứu và phân tích sâu về tính chất hóa học đồng thời bắt buộc nắm được các năng lực làm bài bác và những công thức chất hóa học của cơ bản và bí quyết hóa học nâng cấp của từng vừa lòng chất. Quy trình luyện tập sẽ giúp đỡ cho các chúng ta cũng có thể dễ dàng ghi nhớ cùng đồng thời có khả năng làm bài giỏi nhất. Tiếp xúc các với những bài toán hóa học, những cách làm như tính nồng độ mol, nồng độ dung dịch sẽ không còn là điều cạnh tranh khăn so với các bạn.
Trong quá trình luyện tập, các các bạn sẽ nhìn ra quy luật của các công thức và tất cả cách ứng dụng linh hoạt vào cụ thể từng dạng bài bác tập khác nhau. Trong một vài bài toán trắc nghiệm ở lịch trình thi THPT, việcxử lý cấp tốc sẽ giúp chúng ta ghi ăn điểm số cao nhất. Vì chưng vậy, hãy luyện tập thường xuyên và nếu có điều kiện, rất có thể tới chống thí nghiệm để tìm nắm rõ hơn về những công thức hóa.
3.2.Học bí quyết hóa học bởi văn vần
Rất nhiều những công thức hóa đang được những thầy cô gửi thể thành văn vần để học sinh dễ nhớ, dễ thuộc. Biện pháp học này, đã làm sút sự thô khan của những môn học thoải mái và tự nhiên và giúp học viên có hứng thú hơn với bài toán học tập.
Trong quá trình đi học, kiên cố hẳn chúng ta đã được nghe một vài bài văn vần về tính chất tan, nguyên tử khối, hàng đồng đẳng của Metan, bài ca hóa trị…. Hãy nghiên cứu và mày mò thường xuyên để rất có thể sưu tập cho bạn những bài xích văn vần tuyệt và cải thiện vốn kỹ năng hóa học mang đến mình các bạn nhé! Với bí quyết học này, môn hóa vẫn trở nên thuận tiện hơn khôn cùng nhiều.
Ở nội dung bài viết trên đây, là những share sơ lược về công thức hóa học phải nhớđơn giản. Mong muốn vieclam123.vn sẽ đưa về những tin tức hữu ích cho các bạn học sinh, những quý thầy cô và các bậc cha mẹ đang có nhu cầu tìm hiểu.
Xem thêm: Cùng Tìm Hiểu Bột Bánh Dẻo Là Bột Gì ? Các Loại Bột Làm Bánh
Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong một mol hợp chất rồi quy về khối lượng.
Bước 3: Tìm thành phần xác suất các nhân tố trong hòa hợp chất.
Ví dụ: Xác định thành phần tỷ lệ theo trọng lượng của những nguyên tố gồm trong hợp hóa học KNO3
Lời giải
+ $M_KNO_3~$= 39 + 14 + 16.3 = 101 gam/mol
+ trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N với 3 mol nguyên tử O
$+) ext \%K=frac39.100\%101=38,6\%$
$+) ext \%N=frac14.100\%101=13,8\%$
$+) ext \%O=frac16.3.100\%101=47,6\%$ hoặc %O=100% - (38,6% + 13,8%) = 47,6%
II. Xác định công thức hoá học của hòa hợp chất lúc biết thành phần các nguyên tố
Bước 1: Tìm khối lượng mỗi yếu tắc có trong một mol đúng theo chất.
Bước 2: Tìm số mol nguyên tử từng nguyên tố trong một mol hợp chất.
Bước 3: Lập phương pháp hóa học tập của vừa lòng chất.
Ví dụ: Một hơp chất có thành phần những nguyên tố là 40%Cu; 20% S và 40%O. Hãy xác định công thức hoá học của hợp hóa học (biết trọng lượng mol là 160)
Lời giải
- trọng lượng của mỗi nguyên tố trong 1 mol hợp hóa học là:
m
Cu = $frac40.160100 ext=64 ext gam$
m
S = $frac20.160100=32 ext gam$
m
O = $frac40.160100=64 ext gam$
- Số mol nguyên tử của từng nguyên tố trong một mol hợp chất là:
n
Cu = $frac6464$ = 1 mol
n
S = $frac3232$ = 1 mol
n
O = $frac6416$ = 4 mol
Vậy cách làm hoá học tập của hợp chất là: Cu
SO4
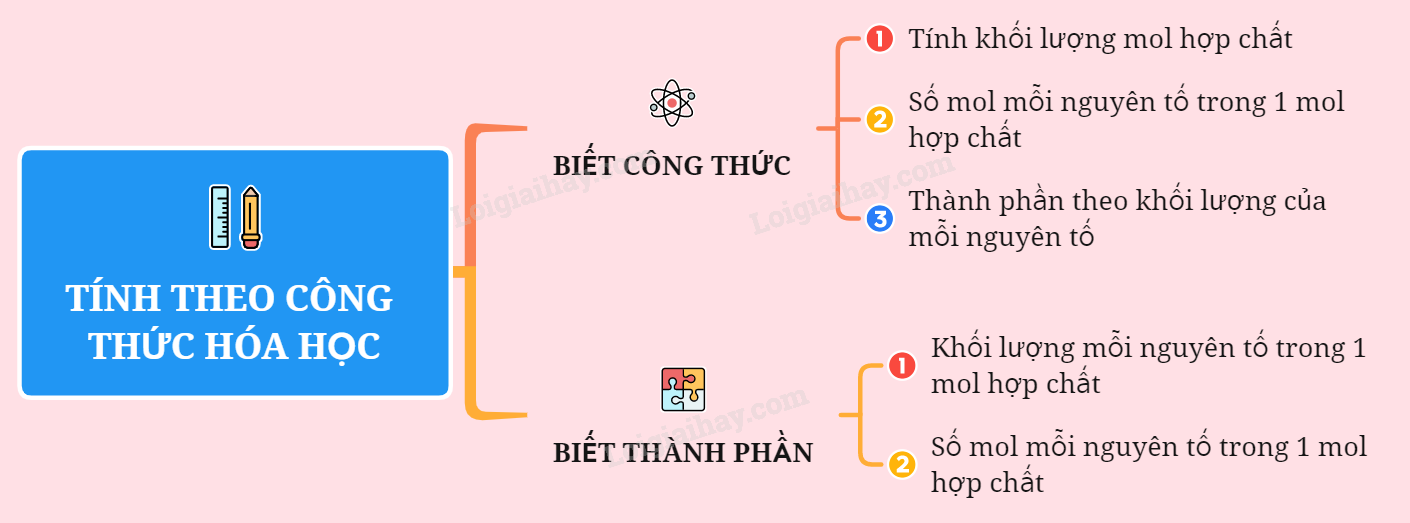
Sơ đồ tứ duy: Tính theo công thức hóa học


Chia sẻ
Bình chọn:
4.3 bên trên 54 phiếu
Bài tiếp theo sau

Luyện bài Tập Trắc nghiệm Hóa lớp 8 - coi ngay
Báo lỗi - Góp ý
 |  |  |  |
 |  |  |  |
TẢI phầm mềm ĐỂ coi OFFLINE


Bài giải new nhất
× Báo lỗi góp ý
Vấn đề em gặp gỡ phải là gì ?
Sai thiết yếu tả
Giải cực nhọc hiểu
Giải sai
Lỗi không giống
Hãy viết chi tiết giúp qhqt.edu.vn
nhờ cất hộ góp ý Hủy quăng quật
× Báo lỗi
Cảm ơn các bạn đã sử dụng qhqt.edu.vn. Đội ngũ giáo viên cần nâng cao điều gì để bạn cho nội dung bài viết này 5* vậy?
Vui lòng nhằm lại tin tức để ad rất có thể liên hệ với em nhé!
Họ với tên:
gửi Hủy vứt
Liên hệ chính sách







Đăng ký để nhận lời giải hay và tài liệu miễn phí
Cho phép qhqt.edu.vn gửi các thông báo đến bạn để nhận thấy các giải thuật hay cũng như tài liệu miễn phí.









