Loạt bài Chuyên đề: Tổng hợp kim chỉ nan và bài xích tập trắc nghiệm Hoá học lớp 10 gồm đáp án được biên soạn theo từng dạng bài xích có đầy đủ: triết lý - cách thức giải, bài xích tập Lý thuyết, bài xích tập trường đoản cú luận và bài xích tập trắc nghiệm gồm đáp án giúp bạn học tốt, đạt điểm cao trong bài kiểm tra và bài bác thi môn Hoá học lớp 10.
Bạn đang xem: Các dạng bài tập hóa 10 và cách giải

Mục lục các dạng bài tập Hoá 10
Chuyên đề: Nguyên tử
Tổng hợp kim chỉ nan chương Nguyên tử
Phương pháp giải những dạng bài tập chương Nguyên tử
Bài tập trắc nghiệm
Chuyên đề: Bảng tuần hoàn những nguyên tố hóa học cùng Định phương tiện tuần hoàn
Tổng hợp kim chỉ nan chương Bảng tuần hoàn các nguyên tố hóa học
Phương pháp giải các dạng bài tập chương Bảng tuần hoàn các nguyên tố hóa học
Bài tập trắc nghiệm
Chuyên đề: link hóa học
Tổng hợp lý thuyết chương links hóa học
Phương pháp giải những dạng bài tập chương link hóa học
Bài tập trắc nghiệm
Chuyên đề: phản ứng lão hóa - khử
Tổng hợp định hướng chương bội nghịch ứng oxi hóa, khử
Phương pháp giải các dạng bài xích tập chương phản nghịch ứng oxi hóa, khử
Bài tập trắc nghiệm
Chuyên đề: team Halogen
Tổng hợp định hướng chương team Halogen
Phương pháp giải các dạng bài tập chương nhóm Halogen
Bài tập trắc nghiệm
Chuyên đề: nhóm Oxi - giữ huỳnh
Tổng hợp định hướng chương team Oxi, lưu giữ huỳnh
Phương pháp giải các dạng bài bác tập chương nhóm Oxi, lưu giữ huỳnh
Bài tập trắc nghiệm
Chuyên đề: vận tốc phản ứng và thăng bằng hóa học
Tổng hợp lý thuyết chương vận tốc phản ứng và cân bằng hóa học
Phương pháp giải các dạng bài xích tập chương vận tốc phản ứng và thăng bằng hóa học
Bài tập trắc nghiệm
Xác định nguyên tố phụ thuộc vào số hạt
A. Phương thức & Ví dụ
Nguyên tử của mỗi nguyên tố có một vài Z đặc trưng nên để xác minh nguyên tố ta cần khẳng định Z thông qua việc lập và giải phương trình về số hạt.
a) Dạng toán cơ bản cho 1 nguyên tử
Phương pháp:
- căn cứ vào Z sẽ xác định được nguyên tử đó là thuộc nguyên tố hóa học nào
- giữ ý: Z = số proton (p) = số electron (e) = E
Số khối: A = Z + N
Tổng số phân tử = 2.Z + N
toàn bô hạt mang điện = Z + E = 2Z
Ví dụ 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong những số đó tổng số hạt có điện nhiều hơn nữa số phân tử không với điện là 22. Vậy X là
Hướng dẫn:
Ta có: 2.Z + N =82
2.Z - N=22
➢Z = (82+22)/4 =26
➢X là Fe
Công thức vận dụng nhanh: Z = (S + A )/4
Trong đó:
Z: số hiệu nguyên tử
S: tổng thể hạt
A: Hiệu số hạt mang điện với không sở hữu điện
b) Dạng toán áp dụng cho lếu hợp các nguyên tử
Phương pháp:
Nếu là Mx
Yy thì hoàn toàn có thể coi tất cả x nguyên tử M và y nguyên tử Y.
Do đó x.ZX + y.ZY = (Sphân tử + Aphân tử) / 4
Ví dụ 2: Tổng số phân tử cơ phiên bản trong phân tử X gồm công thức là M2O là 140, trong phân tử X thì tổng số hạt sở hữu điện nhiều hơn thế số hạt không có điện là 44. Vậy X là
Hướng dẫn:
Trong X gồm 2 nguyên tử M với 1 nguyên tử O.
Nên ta tất cả : 2.ZM + 8 = (140 + 44) : 4 = 46 &r
Arr; Z =19
&r
Arr; M là K &r
Arr; X là K2O
Áp dụng mở rộng công thức bên trên trong giải ion
➢ nếu như ion là Xx+thì ZX = (S + A+ 2x) / 4
➢ giả dụ ion Yy-thì ZY = (S + A – 2y) / 4
Vậy khác biệt của cách làm này cùng với công thức thuở đầu đó là thêm giá trị của năng lượng điện ion
Cách nhớ: giả dụ ion dương thì lấy + gấp đôi giá trị năng lượng điện ion dương, nếu như âm thì – gấp đôi giá trị năng lượng điện ion âm)
Ví dụ 3: Tổng số phân tử cơ bản của ion M3+ là 79, trong đó tổng số hạt có điện nhiều hơn thế nữa không mang điện là 19. M là
Hướng dẫn:
ZM = (79 + 19 +2.3) : 4 = 26 &r
Arr; M là fe (Fe).
c) Dạng toán mang lại tổng số hạt cơ bản
Phương pháp:
Với dạng này thì ta phải phối hợp thêm bất đẳng thức:
1 ≤ N/Z ≤ 1,52 (với 82 nguyên tố đầu bảng tuần hoàn)
1 ≤ (S −2Z)/Z ≤ 1,52 &r
Arr; S/3,52 ≤ Z ≤ S/3
Thường với 1 số yếu tắc đầu độ chênh lệch thân p, n, hiếm hoi thường là 1 trong hoặc 2, nên sau khi chia S cho 3 ta hay chon luôn luôn giá trị nguyên sát nhất.
Ngoài ra có thể kết hợp công thức:
S = 2Z + N = Z + (Z + N) tuyệt là S =Z + A
Ví dụ 4: Tổng số phân tử cơ bạn dạng của nguyên tử X là 52, X thuộc đội VIIA. X là
Hướng dẫn:
Z ≤ 52: 3 = 17,33 &r
Arr; Z là Clo (Cl)
ZM ≤ 60:3 = đôi mươi &r
Arr; Ca, ZX ≤ 24 : 3 = 8 &r
Arr; O Vậy MX là Ca
O.
B. Bài tập trắc nghiệm
Câu 1. mang lại nguyên tử X tất cả tổng số phân tử là 34, trong những số ấy số hạt sở hữu điện cấp 1,8333 lần số phân tử không mang điện. Xác minh số khối X?
A. 23 B. 24 C. 27 D. 11
Lời giải:
Đáp án: A
Ta gồm tổng số phân tử trong nguyên tử: p + N + E = 34
Mà p. = E = Z &r
Arr; 2Z + N = 34
Mặt không giống số hạt có điện vội vàng 1,8333 lần số phân tử không sở hữu điện nên:
2Z = 1,8333N &r
Arr; 1,8333N + N = 34 &r
Arr; N = 12 &r
Arr; Z = 11
Vậy X có Z = 11 cần điện tích hạt nhân là 11+
Số khối của X: A = Z + N = 23
Câu 2. Một nguyên tử yếu tố A có tổng số proton, nơtron, electron là 52. Kiếm tìm nguyên tố A.
A. Mg B. Cl C. Al D. K
Lời giải:
Đáp án: B
Ta có: 2Z + N = 52
Do vấn đề có nhì ẩn nhưng mà chỉ tất cả một dữ kiện nhằm lập phương trình bắt buộc ta thực hiện thêm giới hạn
1 ≤ N/Z ≤ 1,222 giỏi 52/3,222 ≤ Z ≤ 52/3 &r
Arr; 16,1 ≤ Z ≤ 17,3.
Chọn Z = 17 &r
Arr; N = 18 &r
Arr; A = 35 (nguyên tố Clo)
Câu 3. Nguyên tử của yếu tắc X tất cả tổng số hạt là 40 .Tổng số hạt với điện nhiều hơn tổng số phân tử không mang điện là 12 hạt. Nhân tố X gồm số khối là :
A. 27 B. 26 C. 28 D. 23
Lời giải:
Đáp án: A
p + n + e = 40 vì phường = e &r
Arr; 2p + n = 40 (1)
Hạt mang điện: p. + e = 2p
Hạt không có điện: n.
Theo bài: 2p – n = 12(2)
Từ 1 với 2 &r
Arr; p = e = 13; n = 14 &r
Arr; A = phường + n = 27
Vậy, sắt kẽm kim loại X là Ca, Y là Fe.
Câu 4. Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X cùng Y là 142, trong số ấy tổng số hạt có điện nhiều hơn nữa tổng số hạt không có điện là 42. Số hạt với điện của nguyên tử Y nhiều hơn thế nữa của X là 12. Hai kim loại X, Y lần lượt là
A. Na, K.B. K, Ca.C. Mg, Fe.D. Ca, Fe.
Lời giải:
Đáp án: D
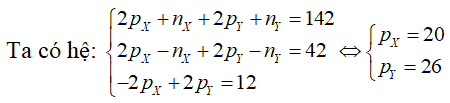
Câu 5. Tổng số hạt proton, nơtron với electron vào nguyên tử yếu tố X là 155, trong các số ấy số hạt sở hữu điện nhiều hơn số hạt không có điện là 33 hạt. X là yếu tố nào sau đây ?
A. Al
B. Fe
C. Cu
D. Ag
Lời giải:
Đáp án: D
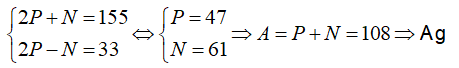
Câu 6. Một ion X3+ bao gồm tổng số phân tử proton, nơtron, electron là 79, trong những số ấy số hat với điện nhiều hơn thế số hạt không với điện là 19. Viết kí hiệu của nguyên tử X.
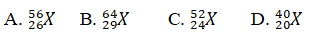
Lời giải:
Đáp án: A
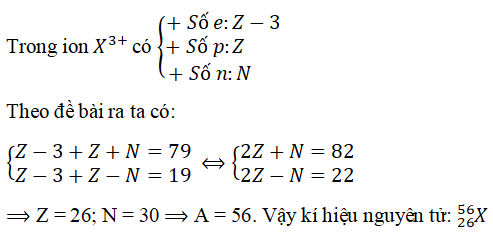
&r
Arr; Z = 26; N = 30 &r
Arr; A = 56. Vậy ki hiệu nguyên tử: 2656)X
Câu 7. Tổng số các hạt vào nguyên tử M là 18. Nguyên tử M tất cả tổng số hạt mang điện gấp hai số hạt không mang điện. Hãy viết kí hiệu nguyên tử M.
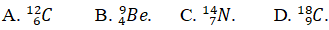
Lời giải:
Đáp án: A
Tổng số hạt trong nguyên tử : p. + N + E = 18
Mà p. = E = Z &r
Arr; 2Z + N = 18
Măt khác tổng số hạt với điện gấp rất nhiều lần số phân tử không có điện
2Z = 2N &r
Arr; Z = N = 6 &r
Arr; A = 12
Kí hiệu nguyên tử M: 612C.
Câu 8. mỗi phân tử XY2 gồm tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt sở hữu điện nhiều hơn thế nữa số phân tử không sở hữu điện là 54, số hạt với điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác minh kí hiệu hoá học tập của X,Y theo thứ tự là
A. Fe và SB. S cùng OC. C cùng OD. Pb cùng Cl
Lời giải:
Đáp án: A
Kí hiệu số đơn vị chức năng điện tích phân tử nhân của X là ZX , Y là ZY ; số nơtron (hạt không có điện) của X là NX, Y là NY . Với XY2 , ta có những phương trình:
tổng số phân tử của X và Y là: 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
Số hạt có điện nhiều hơn không sở hữu điện là: 2.ZX + 4.ZY - NX – 2.NY = 54 (2)
Số hạt sở hữu điện của X ít hơn số hạt mang điện của Y là: 4.ZY – 2.ZX = 12 (3)
ZY = 16 ; ZX = 26
Vậy X là sắt, Y là lưu hoàng &r
Arr; XY2 là Fe
S2
Xác định thành phần nguyên tử
A. Phương pháp & Ví dụ
Lý thuyết và phương pháp giải
- phụ thuộc kí hiệu nguyên tử ra suy ra số phân tử mỗi một số loại trong nguyên tử hoặc dựa vào cấu trúc của nguyên tử, ion tương xứng để lập phương trình, giải phương trình kiếm tìm số hạt.
Lưu ý: Kí hiệu nguyên tử: ZAX
Sơ đồ: M → Mn+ + ne (với n là số electron bởi M nhường)
X + me → Xm- ( với m là số electron vì X nhận)
Ví dụ minh họa
Ví dụ 1. Nguyên tử Ca có 20 notron, trăng tròn proton. Số hiệu nguyên tử của Ca là:
A. Trăng tròn B. 16 C. 31 D. 30
Hướng dẫn:
Số hiệu nguyên tử Z đó là số proton.
Đáp án A
Ví dụ 2. cho biết thêm nguyên tử của thành phần A tất cả tổng số phân tử là 58, số khối của nguyên tử nhỏ hơn 40. Hãy xác định số proton, số nơtron, số electron vào nguyên tử.
Hướng dẫn:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3&r
Arr; 18 ≤ Z ≤ 19,3 &r
Arr; Z = 18; Z = 19
Nếu Z = 18 &r
Arr; N = 22 &r
Arr; A = 40 (loại)
Nếu Z = 19 &r
Arr; N = 20 &r
Arr; A = 39 (nhận)
⇒ Nguyên tử A bao gồm 19p, 19e, 20n.
Ví dụ 3. hạt nhân của nguyên tử nhân tố A có 24 hạt, trong các số ấy số hạt không sở hữu điện là 12. Tính số electron trong A.
A. 12 B. 24 C.13 D. 6
Hướng dẫn:
Số khối A = Z + N =24
Biết N = 12 &r
Arr; E = Z = 24 - 12 = 12
Ví dụ 4. Nguyên tử X gồm ký hiệu 2964X. Số notron vào X là:
Hướng dẫn:
2964X &r
Arr; Z = 29, A = 64 cần N = A - Z = 64 - 29 = 35 hạt
B. Bài bác tập trắc nghiệm
Câu 1. Nguyên tử X bao gồm 35 proton, 35 electron, 45 notron. Số khối của nguyên tử X là:
A. 80 B.105 C. 70 D. 35
Lời giải:
Đáp án: A
Số khối A = Z + N = 35 + 45 = 80
Câu 2. Xác định số notron trong nguyên tử oxi biết O tất cả 8 proton:A.8 B. 16 C.6 D.18
Lời giải:
Đáp án: A
Số proton: Z = A – N = 16 – 8 = 8
Câu 3. Trong nguyên tử A, số hạt với điện tích dương là 13, số phân tử không mang điện là 14. Số phân tử electron trong A là bao nhiêu?
A. 13 B. 15 C. 27 D.14
Lời giải:
Đáp án: A
Số e = Số phường = 13.
Câu 4. Trong anion X3- tổng số những hạt 111; số electron bởi 48% số khối. Tra cứu số proton, số electron, nơtron và tìm số khối A của X3-.
Lời giải:
Đáp án:
Từ X + 3e → X3-nên tổng số hạt trong X là: 111 – 3 = 108
Ta có 2Z + N = 108(1)
Mặt khác vị số electron bằng 48% số khối nên:
Z + 3 = 48%(Z + N) &h
Arr; 52Z + 300 = 48N hay 13Z + 75 = 12N(2)
Từ (1) với (2) &r
Arr; Z = 33; N = 42 &r
Arr; A = 33 + 42 =75
X + me → Xm- ( với m là số electron vị X nhận)
Câu 5. Cho biết nguyên tử của nhân tố A gồm tổng số phân tử là 58, số khối của nguyên tử bé dại hơn 40. Hãy xác minh số proton, số nơtron, số electron trong nguyên tử.
Lời giải:
Đáp án:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3&r
Arr; 18 ≤ Z ≤ 19,3 &r
Arr; Z= 18; Z = 19
Nếu Z = 18 &r
Arr; N = 22 &r
Arr; A = 40 (loại)
Nếu Z = 19 &r
Arr; N = đôi mươi &r
Arr; A = 39 (nhận)
&r
Arr; Nguyên tử A bao gồm 19p, 19e, 20n.
Câu 6. Tổng số hạt với điện trong hợp chất AB là 40. Số hạt mang điện trong nguyên tử nguyên tử A nhiều hơn số hạt với điện vào nguyên tử B là 8. Số proton của A và B lần lượt là
A. 22 với 18B. 12 cùng 8C. 20 và 8D. 12 và 16
Lời giải:
Đáp án: B
Tổng số hạt mang điện trong hợp hóa học AB là 40 → 2p
A + 2p
B = 40
Số hạt mang điện vào nguyên tử nguyên tử A nhiều hơn thế nữa số hạt mang điện trong nguyên tử B là 8 → 2p
A - 2p
B = 8
Giải hệ → p
A = 12, p
B = 8
Câu 7. Một ion X2+ tất cả tổng số phân tử proton, nơtron, electron là 92, trong những số ấy số hạt mang điện nhiều hơn thế số phân tử không với điện là 20. Số phân tử nơtron với electron trong ion X2+ theo lần lượt là
A. 36 cùng 27. B. 36 với 29 C. 29 với 36. D. 27 cùng 36.
Lời giải:
Đáp án: A
Giải hệ
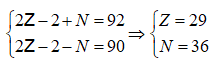
X tất cả 29e thì nhường nhịn 2e được X2+ còn 27e , số notron không đổi
Câu 8. xác minh thành phần cấu tạo của các nguyên tử sau:
a. Nguyên tử X bao gồm tổng số các loại hạt bằng 52, trong các số ấy số hạt sở hữu điện nhiều hơn số phân tử không sở hữu điện là 16 hạt.
b. Nguyên tử Y bao gồm tổng số những hạt là 36. Số hạt không với điện thì bởi một nửa hiệu số thân tổng số hạt với số hạt mang điện tích âm?
Lời giải:
Đáp án:
a) hotline p, n cùng e lần lượt là số pronton, nơtron, với electron của X.
Xem thêm: Cách phối đồ nữ đi chơi mùa hè mặc gì cho đẹp, cá tính và mát mẻ
Theo đề bài, ta gồm hệ phương trình:
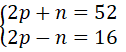
Giải hệ phương trình ta được: phường = 17, n = 18.
Vậy vào X có: 17 electron với 18 nơtron.
b) gọi p, n và e thứu tự là số pronton, nơtron, với electron của Y.
Theo đề bài, ta có hệ phương trình:
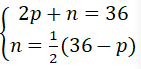
Giải hệ phương trình ta được: p. = 12, n = 12.
Vậy vào X có: 12 proton,12 electron cùng 12 nơtron
Cách viết thông số kỹ thuật electron
A. Cách thức & Ví dụ
Lý thuyết và cách thức giải
- nạm chắc bí quyết viết cấu hình electron nguyên tử dựa vào nguyên lý vững vàng bền, nguyên tắc Pauli với quy tắc Hund:
+ Nguyên lý Pauli: Trên một obital nguyên tử chỉ rất có thể chứa buổi tối đa là nhì electron với hai electron này vận động tự quay không giống chiều nhau xung quanh trục riêng của mỗi electron.
+ Quy tắc Hund: Trong và một phân lớp, những electron sẽ phân bổ trên các obital sao cho số electron đơn côi là tối đa và các electron này phải gồm chiều từ bỏ quay như là nhau.
+ nguyên tắc vững bền: Ở tinh thần cơ bản, vào nguyên tử những electron theo thứ tự chiếm những obital có mức tích điện từ thấp mang lại cao
* quá trình viết thông số kỹ thuật electron nguyên tử
+ khẳng định số electron trong nguyên tử.
+ Phân bố các electron theo đơn lẻ tự mức năng lượng AO tăng dần.
+ Viết cấu hình electron theo đồ vật tự các phân lớp electron trong một lớp.
Ví dụ: 26Fe.
+ tất cả 26e
+ Viết theo riêng biệt tự mức tích điện AO tăng dần:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
+ tiếp đến viết lại theo sản phẩm tự những phân lớp electron trong một lớp:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
+ Viết gọn:
* Chú ý:
+ trật tự những mức tích điện AO tăng vọt như sau:
1s 2s 2p 3s 3p 4s 3 chiều 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
+ Dạng (n – 1)d4ns2 đưa thành (n – 1)d5ns1
(n – 1)d9ns2 chuyển thành (n – 1)d10ns1
* dựa vào số electron ở lớp ngoài cùng để suy ra đặc thù của yếu tắc hóa học.
| Số electron lớp bên ngoài cùng | Tính chất của nguyên tố |
| 1, 2, 3 | Kim loại |
| 4 | Kim một số loại hoặc phi kim |
| 5, 6, 7 | Phi kim |
| 8 | Khí hiếm |
Sơ đồ xuất hiện ion nguyên tử:
M → Mn+ + ne
X + me → Xm-.
Ví dụ minh họa
Ví dụ 1: cho biết thêm số electron buổi tối đa trong một lớp, 1 phân lớp
Hướng dẫn:
*Số electron về tối đa vào một phân lớp
+ Phân lớp s chứa tối đa 2e
+ Phân lớp p. Chứa tối đa 6e
+ Phân lớp d chứa về tối đa 10e
+ Phân lớp f chứa về tối đa 14e
* Số electron buổi tối đa trong một lớp
+ Lớp trước tiên có về tối đa 2e
+ Lớp lắp thêm hai gồm tối đa 8e
+ Lớp thứ tía có tối đa 18e
Ví dụ 2: Nguyên tử X tất cả ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của yếu tố X gồm 8 electron ở phần ngoài cùng.
(2) Nguyên tử của nhân tố X bao gồm 30 nơtron trong phân tử nhân.
(3) X là 1 trong những phi kim.
(4) X là yếu tố d.
Trong các phát biểu trên, phần đa phát biểu đúng là?
A. (1), (2), (3) với (4).
B. (1), (2) cùng (4).
C. (2) cùng (4).
D. (2), (3) cùng (4).
Hướng dẫn:
Do bao gồm sự chèn nấc NL bắt buộc electron được phân bổ như sau:
1s22s22p63s23p6 4s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay
-Số e lớp ngoài cùng là 2 cho nên vì thế X là Kim loại
-N = A – Z = 56 – 26 = 30
-Electron cuối cùng phân bố trên phân lớp 3d nên X là nhân tố d.
&r
Arr; lựa chọn C.
Ví dụ 3: cấu hình electron của nguyên tử yếu tắc X bao gồm dạng
A. X làm việc ô số 15 trong bảng tuần hoàn.
B. X là một trong những phi kim.
C. Nguyên tử của nhân tố X bao gồm 9 electron p.
D. Nguyên tử của yếu tố X bao gồm 3 phân lớp electron.
Hướng dẫn:
&r
Arr; lựa chọn C.
Ví dụ 4: thông số kỹ thuật electron nào sau đây viết sai?
A. 1s22s22p5
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p64s24p5
D. 1s22s22p63s23p63d34s2
Hướng dẫn:
Cấu hình 1s22s2p63s23p64s24p5 thiếu hụt phân lớp 3d. Trước lúc electron được điền vào phân lớp 4p bắt buộc điền vào phân lớp 3d.
&r
Arr; lựa chọn C.
Ví dụ 5: Một nguyên tử của yếu tắc X gồm 3 lớp electron. Phần ngoài cùng bao gồm 4 electron. Xác định số hiệu nguyên tử của X. Viết cấu hình e của X
Hướng dẫn:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Ví dụ 6: Một yếu tắc d gồm 4 lớp electron, phân phần ngoài cùng đã bão hòa electron. Tổng số electron s với electron p. Của nguyên tố này là
Hướng dẫn:
Nguyên tố d có 4 lớp electron → electron sau cuối trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63d
X4s2.
Vậy tổng số electron s cùng electron p là 20
B. Bài xích tập trắc nghiệm
Câu 1. Nguyên tử của yếu tố X bao gồm tổng số hạt electron trong số phân lớp phường là 7. Số hạt có điện của một nguyên tử Y nhiều hơn thế số hạt có điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y
Lời giải:
Đáp án:
Nguyên tử của nhân tố X bao gồm tổng số phân tử electron tron các phân lớp phường là 7
&r
Arr; cấu hình electron của nguyên tử X là: 1s2 2s2 2p6 3s2 3p1
&r
Arr; ZX = 13 &r
Arr; X là Al
- Số hạt với điện cảu một nguyên tử Y nhiều hơn thế nữa số hạt với điên của một nguyên tử X là 8 hạt &r
Arr; 2ZY - 2ZX = 8 ⇔ 2ZY – 2.13 = 8
&r
Arr; ZY = 17 &r
Arr; Y là Cl
Câu 2. nguyên tố X gồm Z = 28, thông số kỹ thuật electron của ion X2+ là:
A. 1s22s22p63s23p64s23d8 B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p6 4s23d6 D. 1s22s22p63s23p63d8
Lời giải:
Đáp án: D
Cấu hình electron của X là 1s22s22p63s23p63d84s2
Cấu hình ion của X2+ là 1s22s22p63s23p63d8
Câu 3. Nguyên tử của nguyên tố X bao gồm electron sinh sống mức tích điện ở mức tối đa là 3p. Nguyên tử của thành phần Y cũng có electron sinh sống mức năng lượng 3p và gồm một electron ở lớp bên ngoài cùng. Nguyên tử X va Y bao gồm số electron hơn hèn nhau 3. Nguyên tử X, Y thứu tự là:
A. Khí hiếm với kim loại
C. Sắt kẽm kim loại và kim loại
B. Kim loại và khí hiếm
D. Phi kim và kim loại
Lời giải:
Đáp án: D
Cấu hình e của Y:
Arr; Y là kim loại
Ta có: ZY = 13 &r
Arr; ZX = 11 &r
Arr; Cấu hình:
&r
Arr; ZX = 15&r
Arr; Cấu hình:
Arr; X là phi kim
Câu 4. Ion Xa+ có tổng số hạt là 80; số hạt sở hữu điện nhiều hơn thế nữa số hạt không sở hữu điện là 20; tổng số hạt trong phân tử nhân của ion Xa+ là 56. Hãy mang lại biết cấu hình electron đúng của Xa+?
A. <18Ar> 3d8B. <18Ar> 3d6C. <18Ar> 3d44s2D. <18Ar> 3d4
Lời giải:
Đáp án: B
Ion Xa+ bao gồm tổng số phân tử là 80 → 2p + n-a = 80
Ion Xa+ có số hạt với điện nhiều hơn số phân tử không với điện là đôi mươi → (2p-a) - n = 20
Ion Xa+ gồm tổng số phân tử trong hạt nhân là 56 → p. + n = 56Giải hệ → phường = 26, n = 30, a = 2
Cấu hình của Xa+ là
Câu 5. yếu tố A có cấu hình electron lớp bên ngoài cùng là 4s1. Thành phần B bao gồm phân lớp cuối là 3p5. Viết thông số kỹ thuật electron rất đầy đủ của A, B. Xác định tên A, B.
Lời giải:
Đáp án:
thông số kỹ thuật electron của A với B:
- yếu tố A bao gồm 3 ngôi trường hợp:
+ không tồn tại electron sinh hoạt 3d:
&r
Arr; cấu hình electron: 1s2 2s2 2p6 3s2 3p6 4s1: Z = 19 (K)
+ có electon sinh sống 3d: bởi vì 4s1 không bão hòa nên:hoặc 3d bán bão hòa: 1s2 2s2 2p6 3s2 3p6 3d5 4s1:Z = 24 (Cr)
hoặc 3 chiều bão hòa: 1s2 2s2 2p6 3s2 3p6 3d10 4s1: Z = 29 (Cu)
- nguyên tố B: 1s2 2s2 2p6 3s2 3p5, B bao gồm Z = 17 là clo (Cl)
Câu 6. Nguyên tử A có e ngơi nghỉ phân lớp 3 chiều chỉ bởi một nửa phân lớp 4s.Cấu hình electron của nguyên tử A là
A.
Lời giải:
Đáp án: A
Số electron về tối đa của phân lớp 4s là 4s2 → số e nghỉ ngơi phân lớp 3d là 3d1
Cấu hình của nguyên tử A là
Câu 7. Nguyên tử M có thông số kỹ thuật electron xung quanh cùng là 3d74s2. Số hiệu nguyên tử của M
A. 24B. 25C. 27D. 29
Lời giải:
Đáp án: C
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27.
Câu 8. Viết thông số kỹ thuật electron của các ion Cu2+, N3-, Fe3+, Cl-,Al3+. Biết số trang bị tự nguyên tố thứu tự là: Cu (Z = 29), N (Z = 7), fe (Z = 26), Cl (Z = 17), Al (Z = 13).
Lớp 1Tài liệu Giáo viên
Lớp 2Lớp 2 - kết nối tri thức
Lớp 2 - Chân trời sáng sủa tạo
Lớp 2 - Cánh diều
Tài liệu Giáo viên
Lớp 3Lớp 3 - liên kết tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu Giáo viên
Tài liệu Giáo viên
Lớp 4Lớp 4 - liên kết tri thức
Lớp 4 - Chân trời sáng tạo
Lớp 4 - Cánh diều
Tiếng Anh lớp 4
Tài liệu Giáo viên
Lớp 5Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
Lớp 6Lớp 6 - liên kết tri thức
Lớp 6 - Chân trời sáng sủa tạo
Lớp 6 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 7Lớp 7 - liên kết tri thức
Lớp 7 - Chân trời sáng tạo
Lớp 7 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 8Lớp 8 - kết nối tri thức
Lớp 8 - Chân trời sáng tạo
Lớp 8 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 9Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng sủa tạo
Lớp 10 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 11Lớp 11 - liên kết tri thức
Lớp 11 - Chân trời sáng sủa tạo
Lớp 11 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 12Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
giáo viênLớp 1
Lớp 2
Lớp 3
Lớp 4
Lớp 5
Lớp 6
Lớp 7
Lớp 8
Lớp 9
Lớp 10
Lớp 11
Lớp 12

Các dạng bài bác tập chất hóa học 10Kết nối tri thức
Chân trời sáng tạo
Cánh diều
Học tốt
Các dạng bài tập chất hóa học 10 (phương pháp giải chi tiết)
Các dạng bài bác tập chất hóa học lớp 10 chọn lọc, tất cả lời giải
Lời giải bài xích tập môn chất hóa học 10 sách mới:
Tài liệu tổng hòa hợp trên 100 dạng bài xích tập hóa học lớp 10 được các Giáo viên những năm tay nghề biên soạn với đầy đủ phương thức giải, ví dụ minh họa với trên 2000 bài tập trắc nghiệm chọn lọc từ cơ bản đến nâng cấp có lời giải sẽ giúp đỡ học sinh ôn luyện, biết phương pháp làm các dạng bài bác tập Hóa lớp 10 tự đó lấy điểm cao trong những bài thi môn chất hóa học 10.
Chuyên đề: Nguyên tử
Phương pháp giải những dạng bài xích tập chương Nguyên tử
Bài tập trắc nghiệm
Chuyên đề: Bảng tuần hoàn các nguyên tố hóa học với Định khí cụ tuần hoàn
Phương pháp giải những dạng bài xích tập chương Bảng tuần hoàn các nguyên tố hóa học
Bài tập trắc nghiệm
Chuyên đề: liên kết hóa học
Phương pháp giải những dạng bài tập chương link hóa học
Bài tập trắc nghiệm
Chuyên đề: bội phản ứng lão hóa - khử
Phương pháp giải các dạng bài xích tập chương phản bội ứng oxi hóa, khử
Bài tập trắc nghiệm
Chuyên đề: đội Halogen
Phương pháp giải các dạng bài tập chương đội Halogen
Bài tập trắc nghiệm
Chuyên đề: đội Oxi - lưu giữ huỳnh
Phương pháp giải những dạng bài bác tập chương nhóm Oxi, lưu lại huỳnh
Bài tập trắc nghiệm
Chuyên đề: vận tốc phản ứng và cân đối hóa học
Phương pháp giải các dạng bài tập chương tốc độ phản ứng và thăng bằng hóa học
Bài tập trắc nghiệm
ĐỀ THI, GIÁO ÁN, GIA SƯ DÀNH mang đến GIÁO VIÊN VÀ PHỤ HUYNH LỚP 10
Bộ giáo án, bài bác giảng powerpoint, đề thi dành riêng cho giáo viên với gia sư dành riêng cho phụ huynh tại https://tailieugiaovien.com.vn/ . Hỗ trợ zalo Viet
Jack Official









